仪景通光学科技(上海)有限公司品牌商
8 年
手机商铺
- NaN
- 0.5
- 0.5
- 1.5
- 0.5
推荐产品
公司新闻/正文
李晓江团队:利用猴模型发现遗传性帕金森疾病新机制
2056 人阅读发布时间:2021-12-21 17:13
本文作者:暨南大学粤港澳中枢神经再生研究院
杨伟莉 博士 (李晓江团队)
帕金森病 (Parkinson's Disease, PD) 作为仅次于老年痴呆的第二大神经退行性疾病,在全球 65 岁以上人群中的发病率高达 1-2%。其中 PINK1 基因突变可因功能缺失引发青少年型帕金森疾病,所报道的患者最早发病年龄 5 岁,较早的发病进程给患者带来了巨大的生活负担和经济负担。
大量体外研究表明,PINK1 蛋白参与线粒体自噬及线粒体功能调控,然而现有的 PINK1 敲除动物模型尚无法验证这些体外研究中关于 PINK1 调控线粒体自噬的理论,也不能模拟 PD 病人脑中明显神经细胞死亡的病理特征。
因此 PINK1 对线粒体自噬及功能的影响作用尚缺乏体内证据,而建立能够模拟 PD 病人大脑中神经退变病理特征的有效动物模型将有助于理解生理状态下内源性 PINK1 激酶的功能及对线粒体自噬的调控作用。

2021 年 11 月 20 日,暨南大学粤港澳中枢神经再生研究院李晓江团队在 Protein & Cell(IF 14.870)杂志上在线发表了研究长文(Research Article)「PINK1 kinase dysfunction triggers neurodegeneration in the primate brain without impacting mitochondrial homeostasis」(灵长类大脑中 PINK1 激酶的功能异常可造成神经变性而不影响线粒体稳态)。
该项研究利用基因编辑猴模型与死亡人脑组织深入研究帕金森病致病基因 PINK1 的表达与功能,颠覆了长期以来建立在体外与小动物实验基础上的经典理论,为治疗帕金森疾病提供了新的思路及依据。
在该项研究中,研究人员利用建立的 PINK1 猴模型组织、Pink1 敲除小鼠组织及人类组织,通过 Western Blot 及免疫染色观察到截短型 PINK1 蛋白(称为 PINK1-55)仅在灵长类大脑细胞浆中丰富而特异地表达,在灵长类外周组织及小鼠组织中均较难检测到(如图 1 和图 2)。在过去,对 PINK1 体内功能研究面临较大的障碍,主要原因是啮齿类动物及多数细胞系中较难检测到内源性的 PINK1 蛋白表达,研究人员只能通过线粒体解偶联剂比如 CCCP 刺激或者通过免疫共沉淀方法才能检测到其表达。
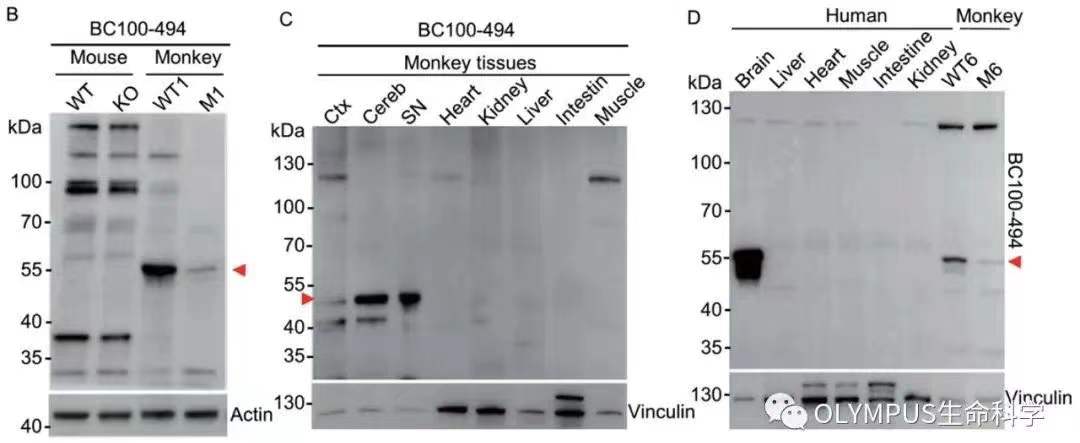
图 1. PINK1 蛋白在小鼠、猴以及人体内的表达情况
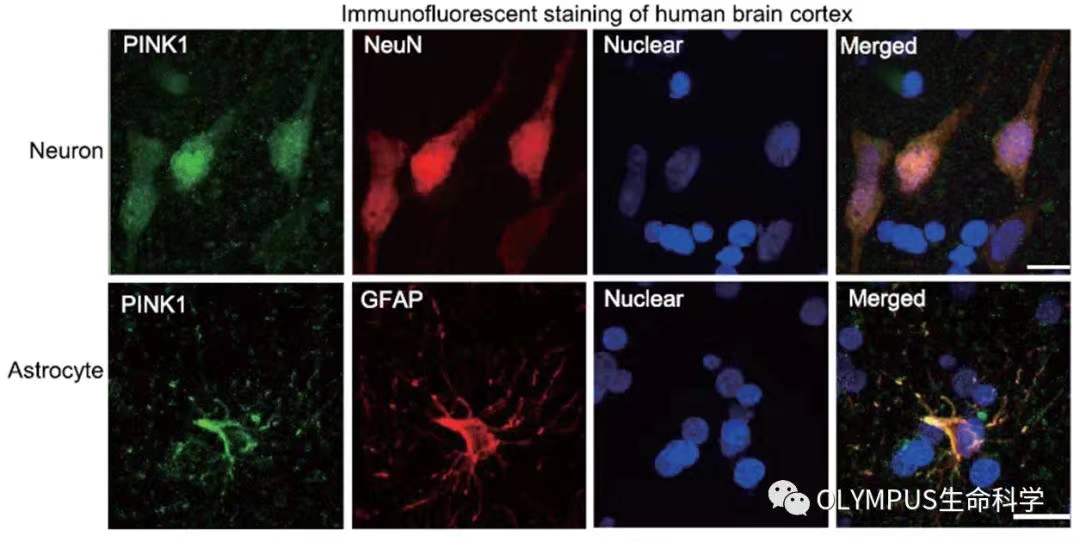
图 2. PINK1 在人类神经元和星形胶质细胞中有表达
(使用 Olympus FV3000 拍摄)
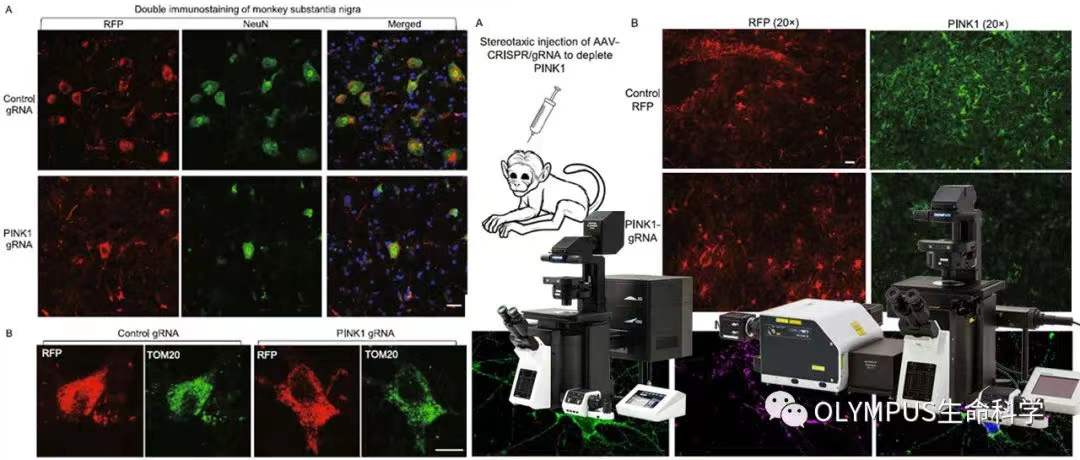
该研究团队使用共聚焦显微镜观察了 PINK1 基因的敲除导致的猴脑内明显的神经缺失现象(如图 3)。在猴脑黑质中,PINK1 基因的敲除还导致了大尺度的 NeuN 阳性神经元细胞的缺失(如图 4A)。但有趣的是,在存活的神经元中,研究团队对线粒体蛋白(TOM20)进行特异的成像发现其线粒体密度并没有和对照组有明显的差异(如图 4B)。
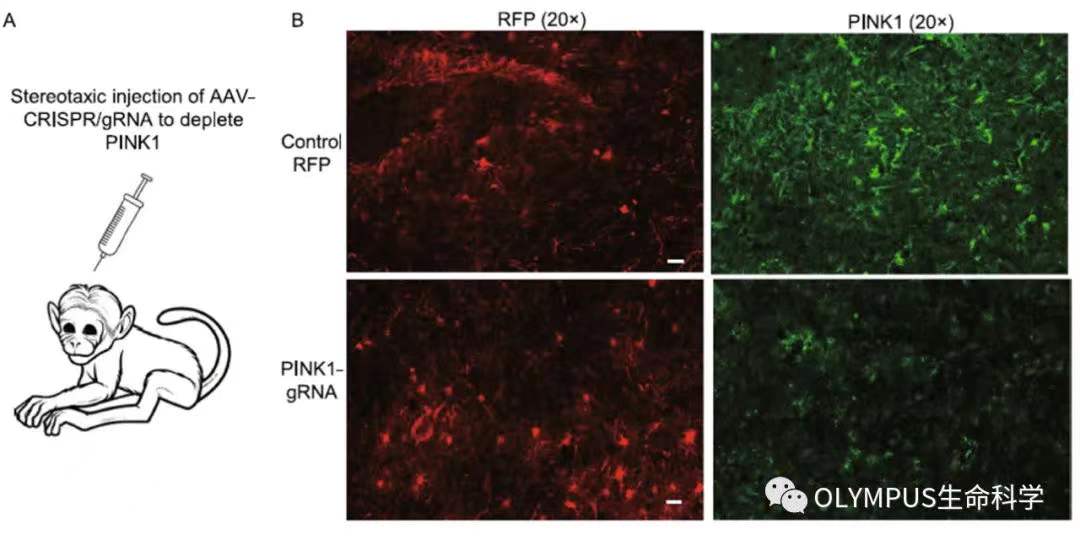
图 3. PINK1 基因的敲除导致的猴脑内明显的神经缺失
(使用 Olympus FV3000 拍摄)
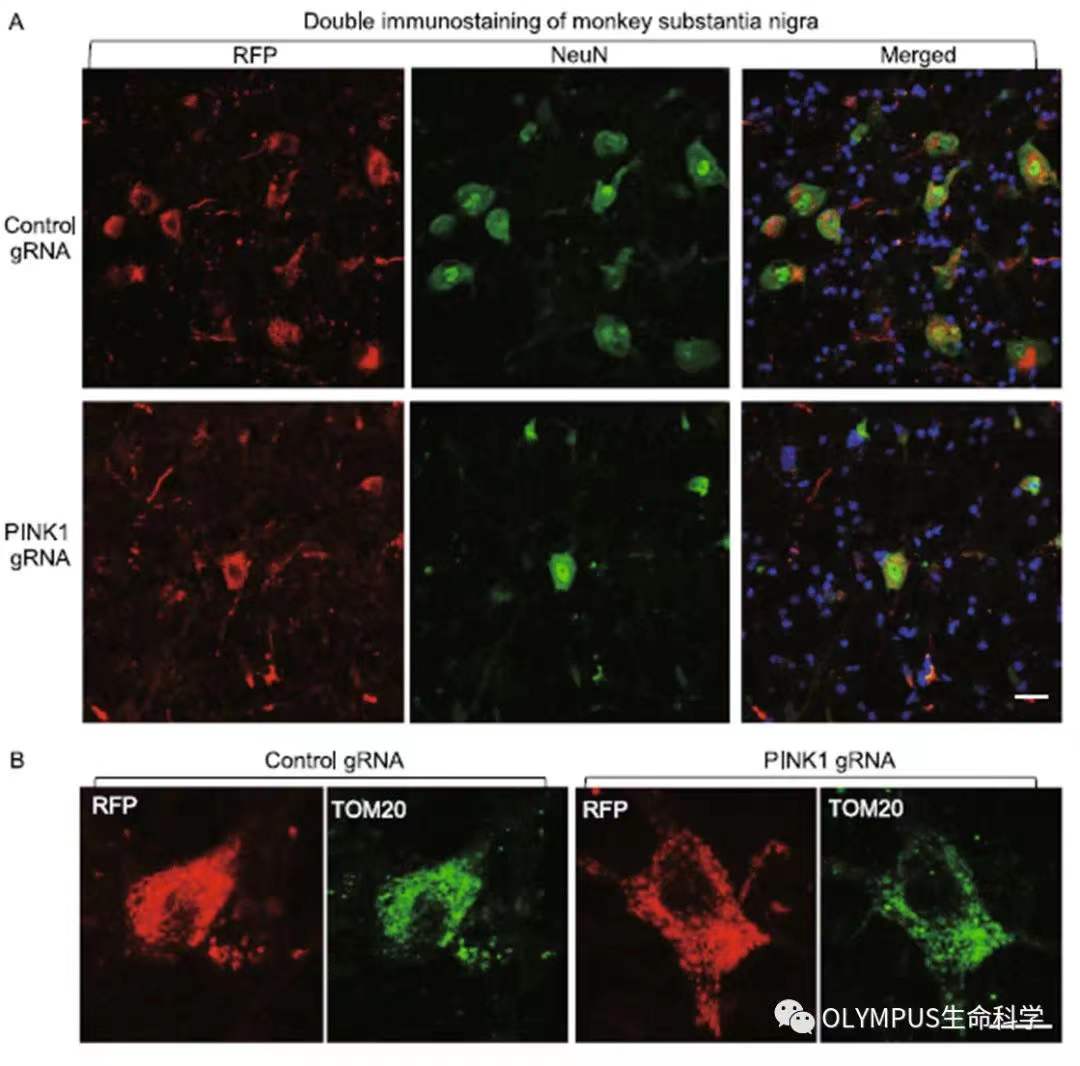
图 4. PINK1 基因的敲除还导致了 NeuN 阳性的神经元细胞的缺失(A)PINK1 敲除组的线粒体密度和对照组并无明显区别 (B)(使用 Olympus FV3000 拍摄)
大量体外研究发现 PINK1 参与线粒体自噬及线粒体功能的调控,而这些研究多基于药物处理。
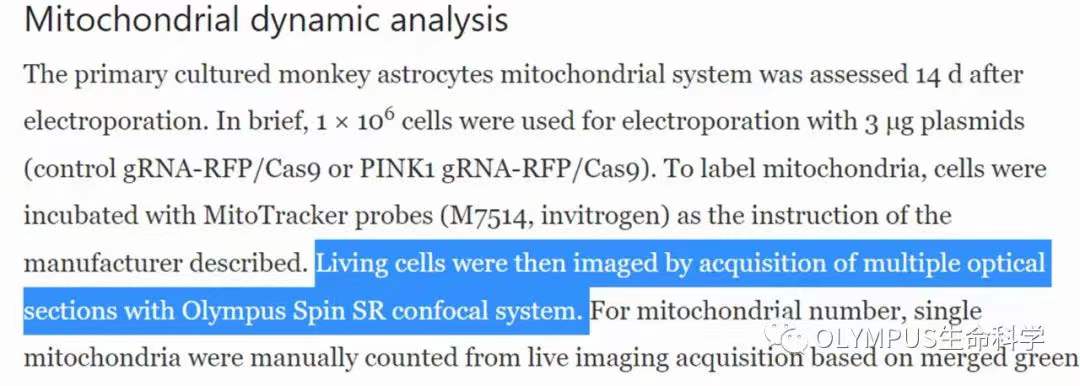
为了证实内源性 PINK1 蛋白在生理状态下对猴大脑的线粒体功能影响,研究人员除了利用电镜观察、Western Blot 方法检测线粒体形态结构及线粒体功能相关蛋白的表达;还利用活细胞显微成像法检测了原代培养的猴胶质细胞中线粒体的动态变化,发现在猴原代胶质细胞中敲除内源性 PINK1 蛋白对胶质细胞线粒体形态,线粒体运动速度及线粒体长度均未有明显影响(如图 5),挑战了过往基于大量体外实验及药物处理下的传统理论。
同时研究人员使用多色荧光成像的方式,进一步观察到内源性 PINK1 蛋白在生理状态下与线粒体几乎没有共定位趋势(图 5B),这样的实验结果揭示了灵长类动物大脑中的 PINK1 蛋白在生理状态下可能具有线粒体之外的重要功能,如作为胞浆中的激酶,通过磷酸化神经细胞功能相关蛋白从而维持细胞的生存。
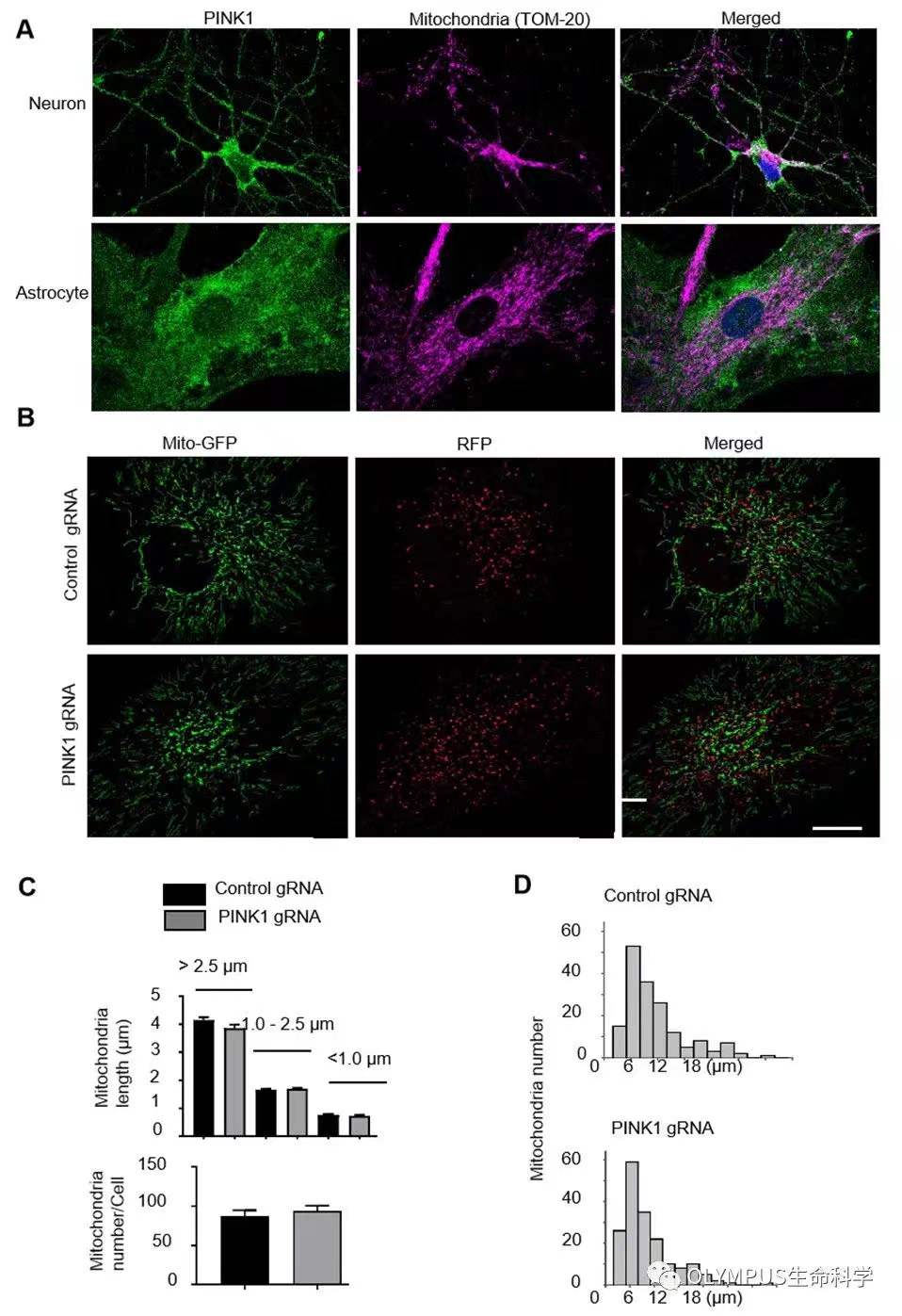
图 5.PINK1 在生理状态下与线粒体无明显共定位,且敲低 PINK1 不影响猴胶质细胞线粒体动态。
(使用 Olympus spinSR 进行数据采集,基于 cellSens 软件数据分析)
本次研究中,研究团队使用了 Olympus 两款共聚焦显微镜,分别是基于点成像的激光扫描共聚焦显微镜 FV3000 和基于面扫描的转盘型激光共聚焦显微镜 spinSR。鉴于 FV3000 显微镜具有出色的光谱检测性能和一目了然的操作方式,主要用于脑片和其他固定样品的多色高清成像。
另一方面,在对原代胶质细胞进行活细胞成像时,为了尽可能维持细胞的生命状态,和捕捉到线粒体聚合/分裂的快速动态变化,研究团队选择使用 spinSR 共聚焦显微镜进行数据采集。相比于常规的共聚焦显微镜,spinSR 可以同时满足高分辨率、快速拍摄、低光毒性的要求,特别适合活细胞。








